RESEARCH 研究詳細 藤村卓准教授
メラノーマなど皮膚がん全般における新規治療法・診断法の開発
PAI-1阻害薬を用いたメラノーマに対する新規ニボルマブ強化療法の開発
日本国内の約半数の悪性黒色腫は末端黒子型であり、欧米で多い表在拡大型に比べて体細胞変異数が少ないため、国内の根治切除不能悪性黒色腫患者では、ニボルマブなどの抗PD-1抗体単剤療法による治療が効きづらいです。現在、抗CTLA4抗体(イピリムマブ)が保険適用され、そのニボルマブとの併用がニボルマブ単剤と比べて高い奏効率を示していますが、その約60%の患者で重度の免疫関連副作用により、数ヶ月に及ぶ入院や癌に対する治療の停止が社会問題になっています。さらに、高額医療費の課題もあり、抗体薬とは異なる経口投与可能で、副作用がなく、奏効率を上昇させ、抗体より安価な併用薬が望まれています。
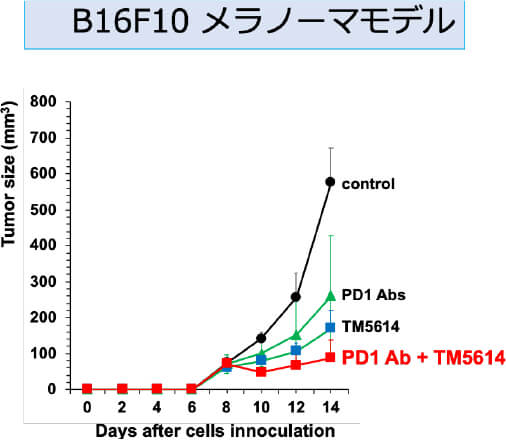
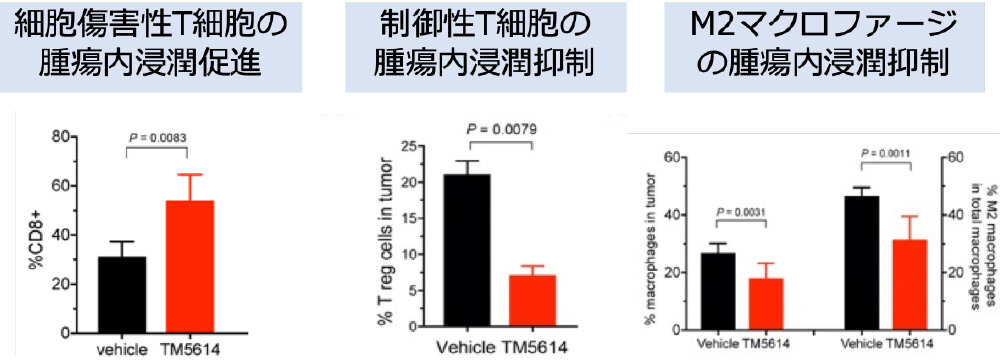
私たちの研究室では新規低分子経口PAI-1阻害薬TM5614が、メラノーマ細胞株を移植したマウス悪性黒色腫モデルにおいて、抗PD-1抗体の悪性黒色腫に対する治療効果を増強することを証明しました(図1)。
図1
マウスによる証明 TM5614は抗PD-1抗体の効果を増強する
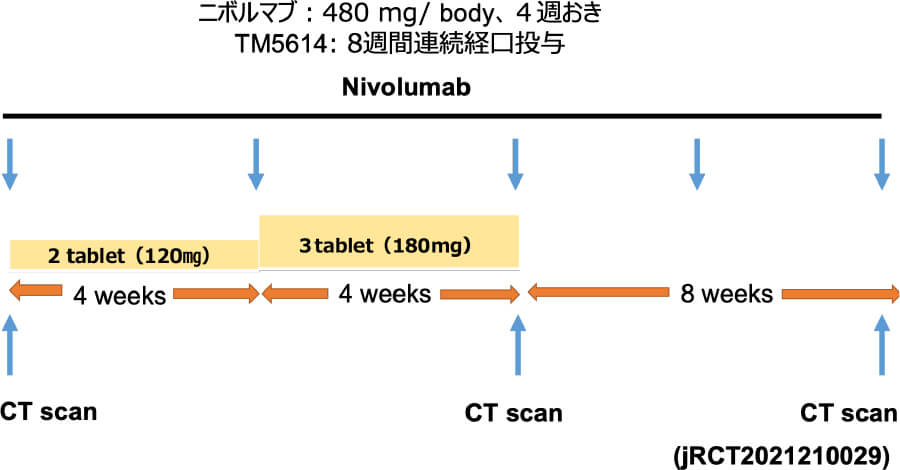
人への応用 ニボルマブ+TM5614臨床試験
TM5614は東北大学大学院医学系研究科分子病態治療学分野の宮田敏男教授が完全にアカデミアで開発された薬剤であり、現在慢性骨髄性白血病や血管肉腫、肺がんなど他癌種でも開発が進められいる薬剤です。そのメカニズムは図1に示すように、TM5614は抗PD-1抗体が作用し易いように腫瘍内免疫環境を改善していると考えられます。このことはニボルマブ+イピリムマブの2種類の免疫チェックポイント阻害薬の併用により重度の免疫関連副作用が出現するのに対して、ニボルマブ+TM5614の併用では両薬の作用機序は異なっており、またTM5614と抗PD-1抗体の薬剤相互作用が生じる可能性も理論的になく、重度の有害事象が起こる可能性は低いことが示唆されました。
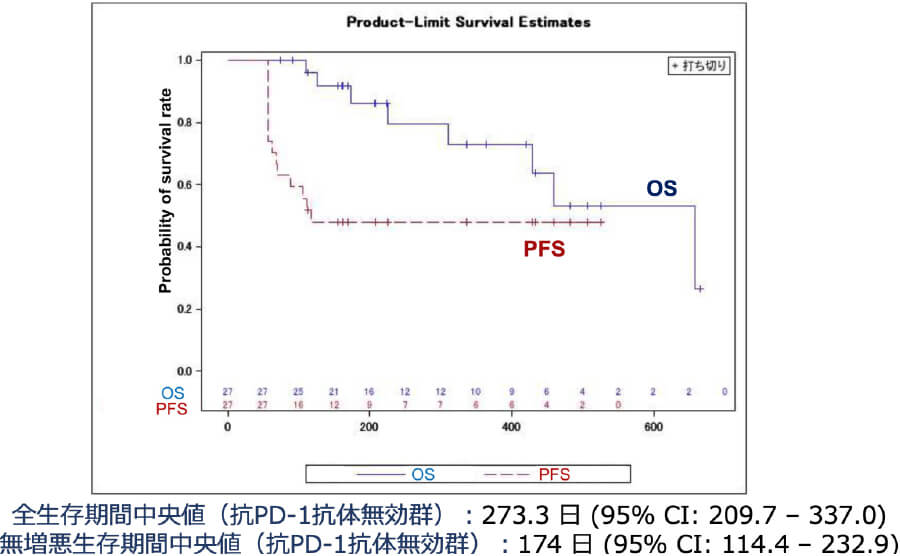
以上から、2021年9月〜2023年3月まで、全国7施設で東北大学皮膚科が中心となり、AMED橋渡し研究シーズCの支援のもと、多施設共同医師主導治験(第II相)を行いました。その結果、PAI-1阻害薬であるTM5614の併用は、抗PD-1抗体薬であるニボルマブが無効となったメラノーマ患者の25.9%に効果があり、併用期間が2ヶ月であるにも関わらず半数の患者が6ヶ月間再発なく経過しました(図1)。これは、TM5614がニボルマブの耐性を解除したことを示唆します。今後この研究に続き、2025年3月より、検証的第III相試験として、東北大学皮膚科が代表となり、全国18施設とともに3年計画で行う予定です。
PAI-1阻害薬を用いた再発性難治性血管肉腫に対する治療法の開発
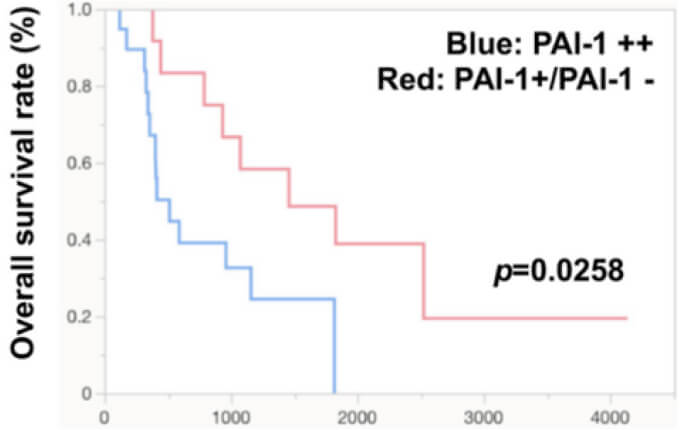
PAI-1は主として血管内皮で産生されます。皮膚血管肉腫は稀な軟部腫瘍(日本における年間発症数は300名程度)で、アポトーシス誘導剤のタキサン系抗がん剤が第1選択薬となっています。しかし、タキサン系抗がん剤を使用した90例の皮膚血管肉腫の予後を検討した結果、全生存率は649日と治療効果はわずかであり、新たな治療薬の研究開発が急がれます。
そこで、新薬開発のための研究を進めたところ、PAI-1の発現が疾患の予後と強く相関していることに気づきました。実際にPAI-1を高発現するがん細胞ではアポトーシス耐性になっていることからも、PAI-1阻害剤を併用することで、タキソール系抗がん剤の血管肉腫治療効果を増強できる可能性が強く示唆されました。以上から私たちの研究室では、タキソール系抗がん剤パクリタキセルが無効となった皮膚血管肉腫患者を対象に、PAI-1阻害薬TM5614の有効性を確認する第II相試験(医師主導治験)を多施設共同研究として2023年9月より開始しました。本研究でTM5614の有効性を示せれば、有効な治療薬の無い皮膚血管肉腫患者に対して新たな治療法が提案できます。タキサン系抗がん薬が無効となった皮膚血管肉腫に対して現在、有効な治療法はないため、この研究により、血管肉腫の新たな治療法を私たちの研究室から作り出せる可能性があります。
能動的精密表面温度計測を用いた熱パルスレーダ-による
皮膚腫瘍の鑑別診断に関する臨床開発
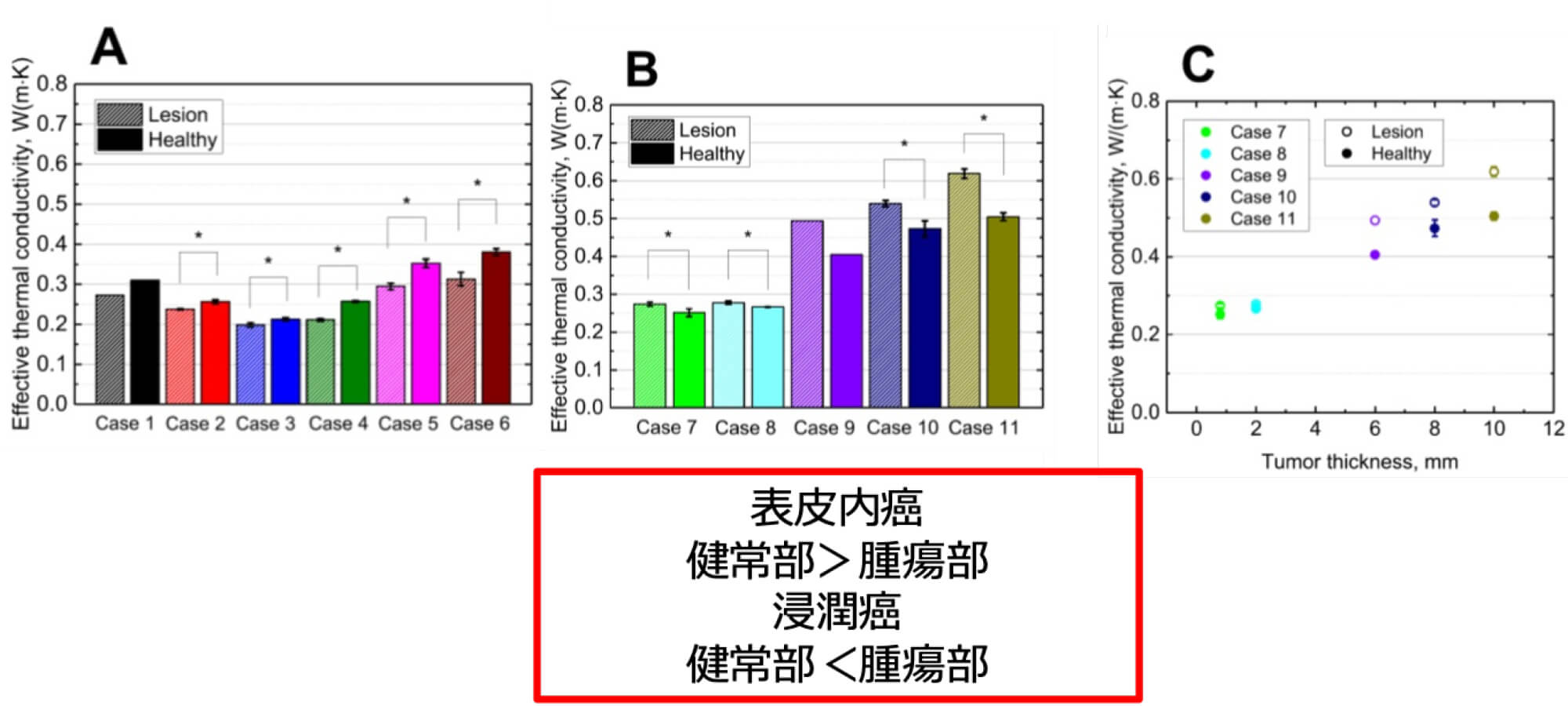
現在の診療で実施されている視診とダーモスコピー検査のみでは腫瘍浸潤度を決定することが難しく、生検を行って確定診断及び腫瘍浸潤度を決定しておりますが、開発中のこの診断機器により非侵襲的に良/悪性及び腫瘍浸潤度の診断を鑑別し、表皮内悪性腫瘍疑い及び良性腫瘍であれば、不要な多くの検査を省き、原発巣切除までの診療ステップを早め、早期病変に対する早期対処が可能になります。また不要な多くの検査を省くことで、患者さんの負担を減らすことができます。この開発機器は、悪性黒色腫と健常皮膚の熱伝導率の差に着目し、等価熱伝導率という客観的指標で、腫瘍の良/悪性及び真皮浸潤の有無を非侵襲的に早期に鑑別することを目的に、AMED医療機器開発推進研究事業の支援(2024年〜2027年)のもと現在、東北大学流体科学研究所名誉教授の圓山重直先生を始めとし、弘前大学多様系熱流体工学分野の岡部孝裕先生、八戸高等専門学校産業システム工学科の野中崇先生、井関裕也先生のご協力の上、開発を進めており、2025年1月より探索的医師主導治験でその性能を確認する予定です。なお、平成 31 年度橋渡しシーズ C の支援を受け実行したプロトタイプの機器について探索的研究を実施し、等価熱伝導率により、表皮内癌又は浸潤癌を判定できることをすでに明らかにしております。
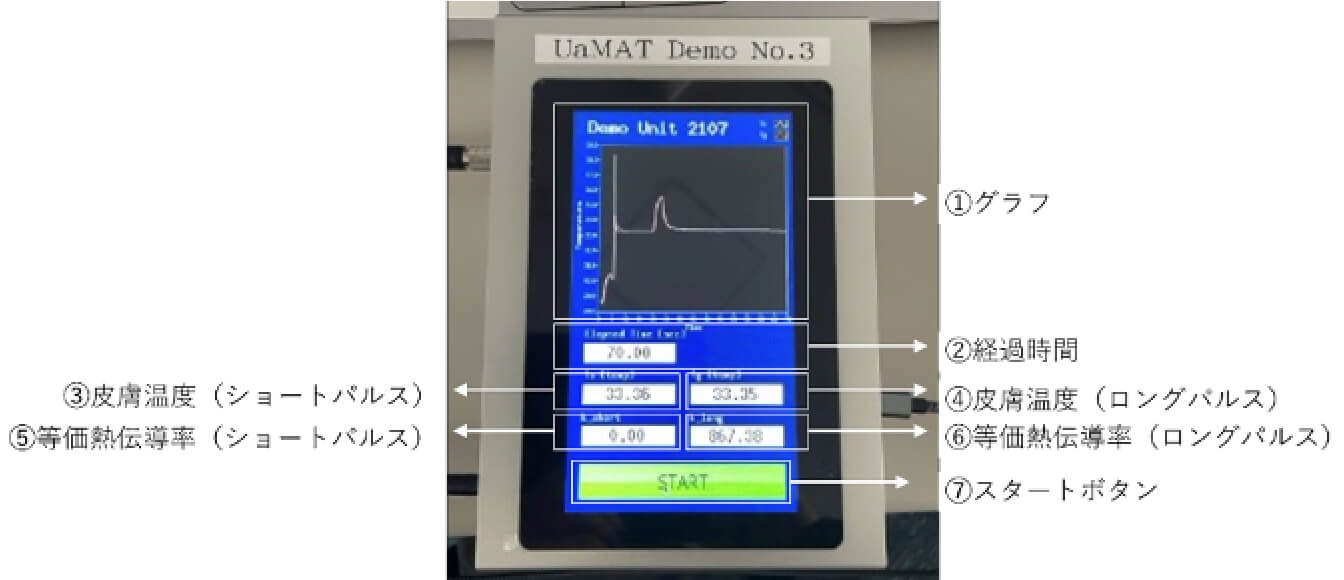
外装カバー(ペン型ハウジング先端)拡大図

現在施行中の皮膚がん全般における基礎研究
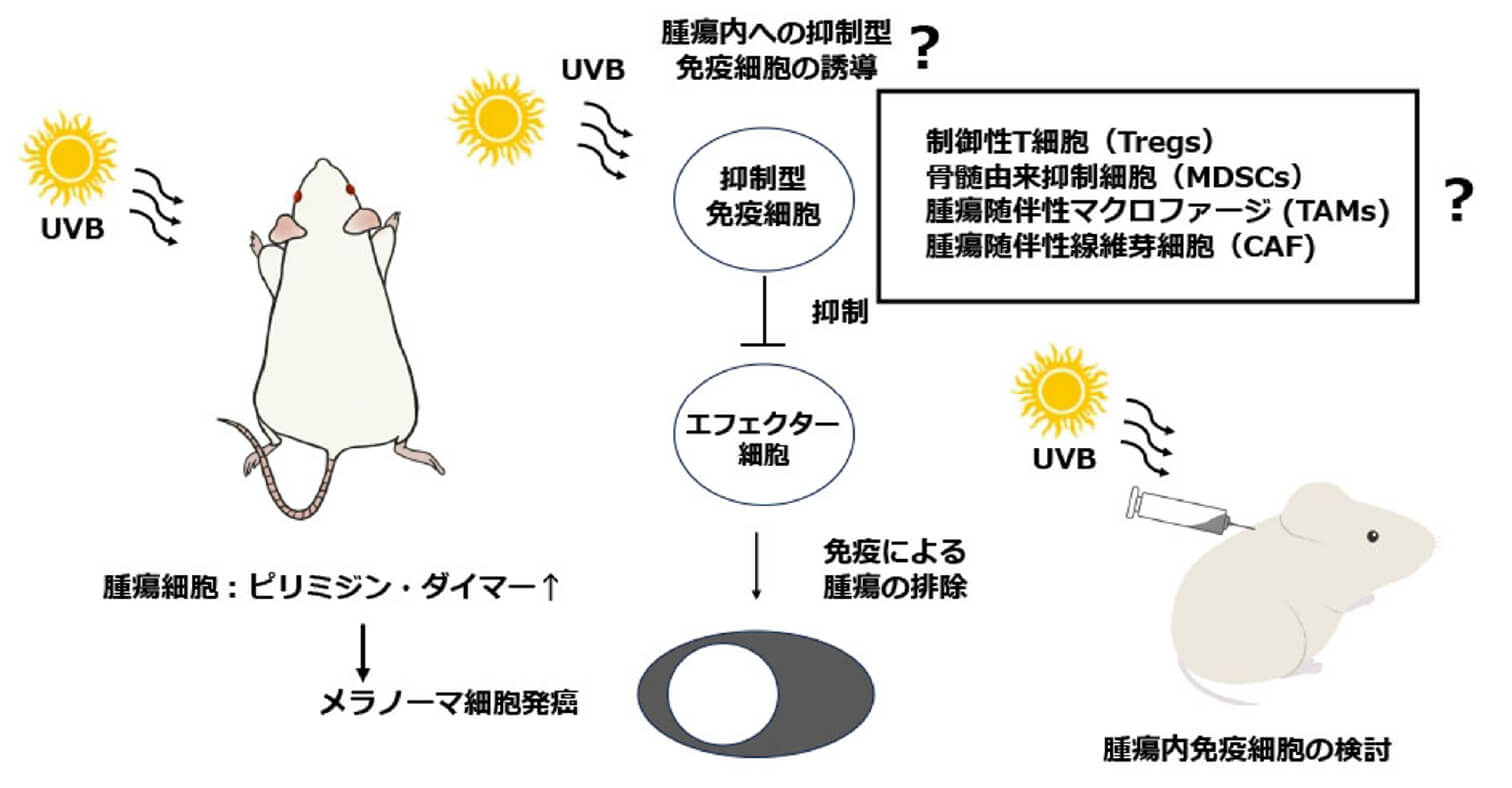
メラノーマ進行における紫外線の役割の解析
本研究は悪性黒色腫(メラノーマ)進行における紫外線暴露の腫瘍免疫環境への影響を明らかにすることを目的に現在、マウスB16F10メラノーマモデルを用いて研究を開始しております。本邦におけるメラノーマの発症率は10万人に1.12人と希少癌に属するが、北欧や豪州では10万人に20〜30人と本邦に比べて数十倍の罹患率を示しております。これは近年のオゾンホールの拡大など環境破壊による紫外線量の増加、日光浴など北欧独特の習慣が一因と考えられます。また紫外線による発癌は古くからその関連性が疫学・分子細胞学で証明されておりますが、発症後の腫瘍の進展への紫外線の関与に関する研究は限られております。加えて、皮膚科学の分野で紫外線は、アトピー性皮膚炎や乾癬など炎症性皮膚疾患の治療にその免疫抑制効果から利用されています。また皮膚がん領域では、免疫チェックポイント阻害薬の出現によりメラノーマの治療は免疫療法が中心的役割を果たしており、メラノーマ治療において腫瘍内微小免疫環境研究の重要性は高まっています。以上の観点から、私たちの研究室では紫外線暴露がメラノーマ腫瘍内微小免疫環境に与える影響をマウスメラノーマモデルで網羅的に検証を進めています。
表皮細胞ストレス応答のメラノーマにおける血管新生亢進への影響
本研究は、足底の荷重部ではメラノーマ発症リスクが高いという疫学的事実から、表皮細胞(ケラチノサイト)の外的刺激によるストレス応答が腫瘍免疫環境に与える影響を検討することにより、メラノーマの発症リスクを回避できるのではないか、という仮説をもとに進めています。
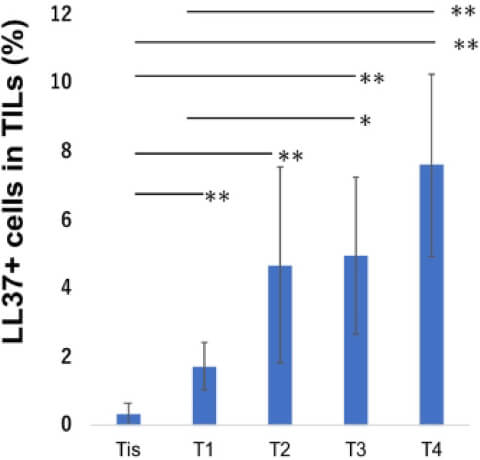
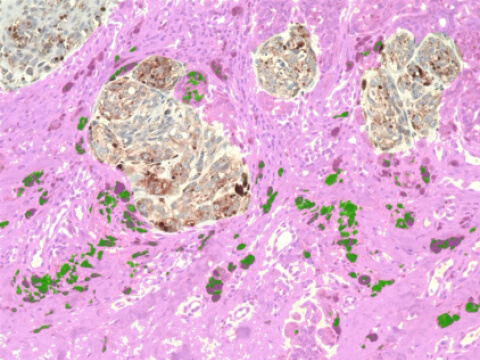
実際、これまで私たちの研究室では、表皮細胞ストレス応答に関わる因子として抗菌ペプチドカセリサイディン(LL-37)シグナルに着目して悪性黒色腫の腫瘍の進行に与える影響を、腫瘍随伴性マクロファージ(Tumor-associated macrophages: TAMs)を中心に解析してきました。TAMsは、様々な癌種において、その癌腫特有の腫瘍内間質関連因子により刺激を受けることにより、その極性を調整し、抑制型の腫瘍免疫環境を形成することが知られています。それゆえ、TAMsは免疫療法の直接的なターゲットになる他、TAMs由来の液性因子が、免疫チェックポイント阻害薬(Immune Checkpoints Inhibitors: ICI)の治療効果、副作用の予測因子としてのバイオマーカーとして報告されています。実際に、これまで私たちの研究室では、抗LL-37が、乳房外パジェット病など上皮系皮膚腫瘍が真皮浸潤を起こした時に上昇することを報告しています。また、LL-37がTAMsに作用し、CCL19などの様々なケモカインを放出し、制御性T細胞など抑制型免疫細胞を遊走し、腫瘍免疫環境を形成することを示してきました。また、LL-37は、IL-17により樹状細胞やマクロファージなど単球由来細胞でその発現が上昇することが知られています。さらに、尋常性乾癬において、LL-37はケラチノサイトで、VEGF-Aを上昇させます。VEGFは、血管新生を促進することに加え、リンパ管の増生にも関与し、腫瘍の増殖を亢進することが知られています。さらに悪性黒色腫が病期進行に伴い、腫瘍内真皮におけるLL-37の発現が増強するか否か、デジタル顕微鏡を用いて定量的に検討したところ、腫瘍の真皮浸潤に伴い、その発現が増強することが明らかとなりました。以上から現在、黒色腫真皮内のmyeloid 細胞におけるLL-37の発現が、黒色腫腫瘍環境に与える影響をマウス黒色腫モデルとヒト単球由来のM2マクロファージを用いて検討し、炎症性皮膚疾患で承認されている抗IL-17抗体が黒色腫の腫瘍免疫に与える影響を調べています。
皮膚がんに幅広く分布する腫瘍随伴性マクロファージ:その臨床応用

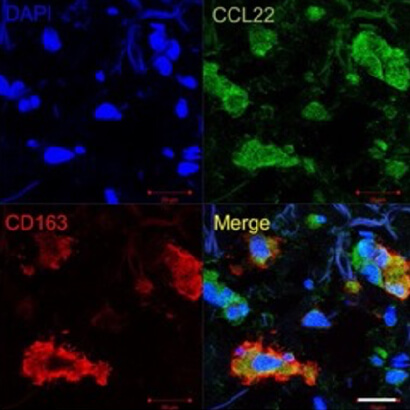

癌種特有に発現する蛋白により機能を獲得し、独自の腫瘍内微小免疫環境を形成することが知られています。私たちの研究室では、ほぼ全ての皮膚がんでCD163陽性TAMsが存在することに着目し、それぞれの癌種で腫瘍由来の蛋白がTAMsに与える影響を検討してきました。中でも乳房外パジェット病では、腫瘍細胞自体がRANKLとMMP7を発現することを私たちの研究室で発見しました。続いて、腫瘍細胞上の膜型RANKLがMMP7によりsRANKLとして放出されていること、sRANKLが腫瘍内のTAMsに作用し、CCL17 (TARC)の産生を亢進することにより腫瘍内に制御性T細胞(Tregs)を誘導しうることを乳房外パジェット病患者検体で証明しました。また、皮膚T細胞性リンパ腫 (cutaneous T cell lymphoma: CTCL)において、早期と進行期における腫瘍内間質のサイトカイン・パターンの違いに着目し、それぞれの病期においてTAMsが産生するケモカインの相違から腫瘍内浸潤細胞が変わること、さらにCTCL治療薬による介入がTAMsのケモカイン産生能に影響し副次的治療効果を発揮しうることを発表しました。他に、メルケル細胞癌、有棘細胞癌、基底細胞癌など多くの皮膚がんにおいてもTAMsが存在することを発表しています。これらの結果を用いて現在、TAMsをターゲットとした癌種横断的皮膚がん治療を目指した治療法の開発を進めています。
腫瘍随伴性マクロファージ:抗PD-1抗体療法の治療効果の予測
免疫チェックポイント阻害薬である抗PD-1抗体は、根治切除不能悪性黒色腫の治療に幅広く使用されています。抗PD-1抗体は、従来の治療薬と比べ一定の奏効率は得ることができるものの、本邦における製版後調査では奏効率が22.2%と臨床試験のデータと比較して低いため、治療効果増強のための併用薬が必要となりますが、現在使用可能なニボルマブ+イピリムマブ併用療法は重度の副作用の発症を伴うため、単剤での治療効果を予測するバイオマーカーの開発が重要です。
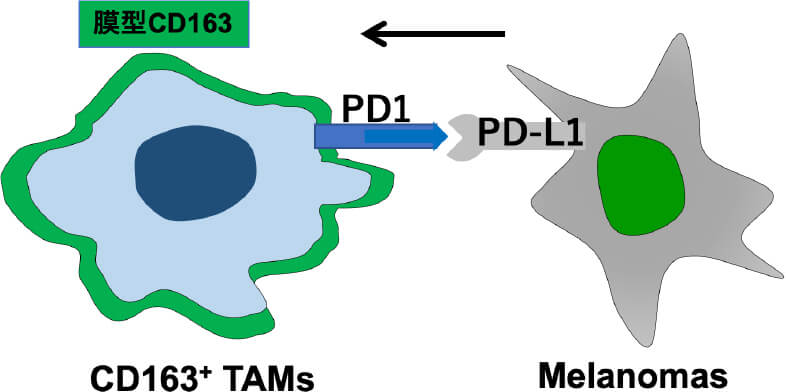
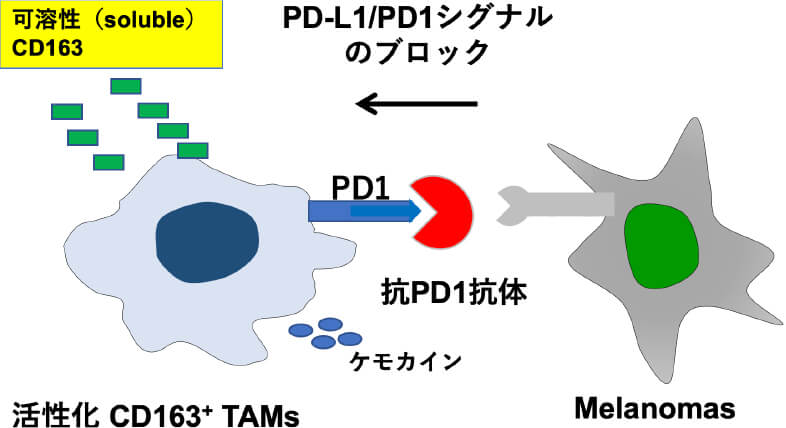
TAMsは皮膚悪性腫瘍の腫瘍内に存在し、その多くはCD163を表面に有するM2型のマクロファージであることが知られています。また、CD163+ TAMsは、細胞表面にPD1を有し、腫瘍側のPD-L1からのシグナルによりM2マクロファージとしての恒常性を維持しているため、抗PD-1抗体により活性化する。活性化したCD163は可溶性CD163 (soluble (s)CD163)として細胞膜から放出されます。以上から、抗PD1抗体投与後の患者血清中sCD163上昇は、抗PD1抗体の悪性黒色腫腫瘍内への到達を意味します。活性化T細胞上のPD-1を抗PD-1抗体でブロックすることにより、腫瘍側のPD-L1からの抑制シグナルを回避し抗腫瘍効果を誘導することが、抗PD-1抗体の作用機序であることから、腫瘍内への抗PD-1抗体の到達は、抗PD-1抗体の抗腫瘍効果の発現に必須です。以上から、抗PD-1抗体治療前後における患者血清中のsCD163を検証したところ、血清中のsCD163およびTAMs関連ケモカインの上昇は、抗PD-1抗体の治療効果を予測するバイオマーカーとなりうることが分かりました。これは2021年に国際特許を取得し、現在体外診断薬として製版準備中です。
M2マクロファージとしての恒常性の維持 TAMsから放出されるsCD163が抗PD-1抗体が腫瘍内に到達したことを示すバイオマーカーになりうる。