RESEARCH 研究紹介
浅野善英教授 Yoshihide Asano
転写因子FLI1の発現異常に基づく全身性強皮症病態一元化仮説
全身性強皮症(以下、強皮症)は皮膚および内臓諸臓器の血管障害と線維化を特徴とする全身性の自己免疫疾患です。国の指定難病に認定されており、その病態解明と治療開発は医学研究者に課された急務の一つです。私は大学院に入学した2000年から現在まで、四半世紀にわたり強皮症の基礎研究に従事してきましたが、その過程で「転写因子FLI1の発現低下」が強皮症の重要な疾病因子の一つであることを見出し、2014年にその主要3病態を忠実に再現する世界初の遺伝子改変マウス(Klf5+/-;Fli1+/-マウス)の作製に成功しました。さらに、8系統の各種細胞(血管内皮細胞、表皮細胞、脂肪細胞、血小板、マクロファージ、B細胞、制御性T細胞、γδT細胞)特異的Fli1欠失マウスを用いた解析を行い、強皮症病態における細胞種間のヒエラルキーについて研究を進めてきました。現在は「Fli1の発現低下」が誘導する細胞種横断的および細胞種特異的な強皮症関連転写ネットワークの同定を目指すとともに、「強皮症関連転写ネットワークを標的とした新規治療戦略」の発案と検証を目標に基礎研究を進めています。
藤村卓准教授 Taku Fujimura
メラノーマなど皮膚がん全般における新規治療法の開発
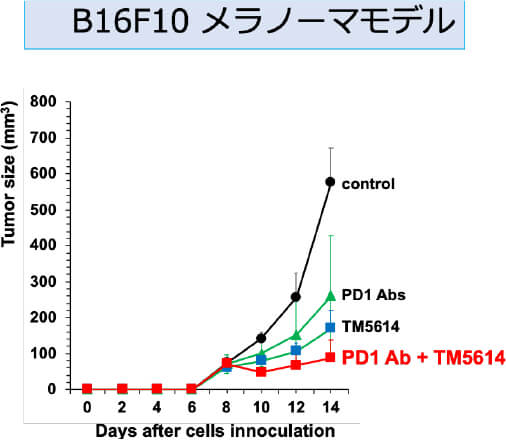
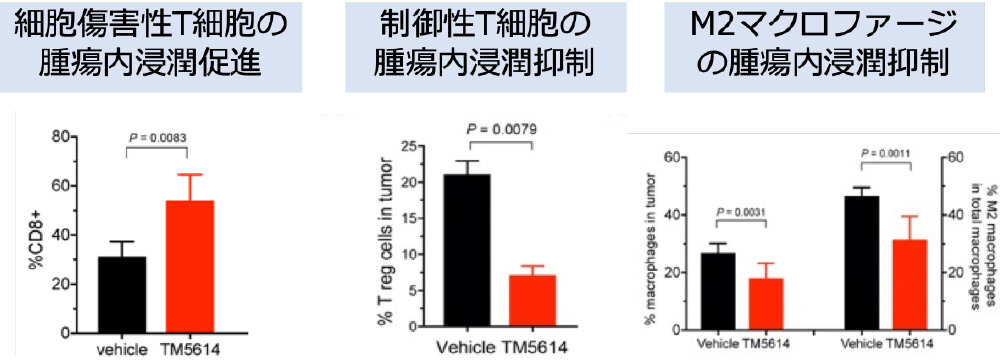
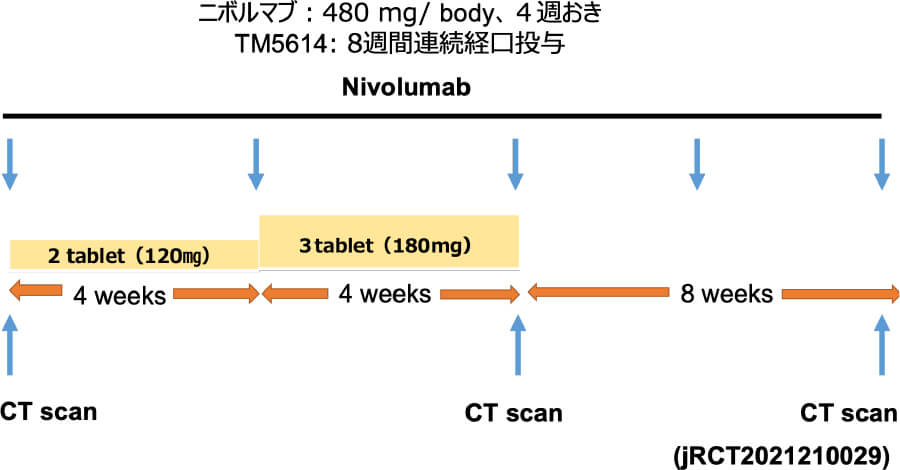
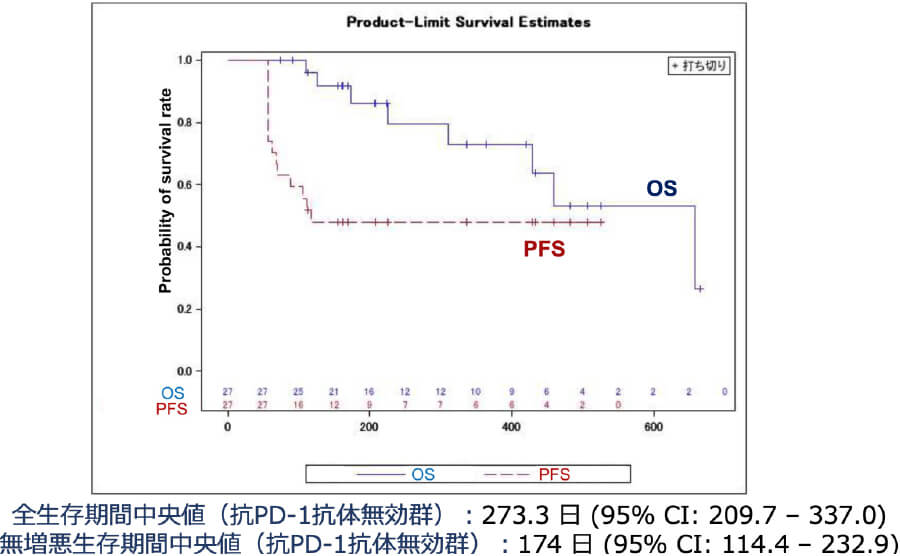
東北大学皮膚科では、メラノーマの基礎研究とその臨床応用を長年行ってきました。その一環で、近年プラスミノゲン・アクティベーター・インヒビター(PAI-1)という分子に着目し、その免疫チェックポイントへの影響を明らかにすることから、PAI-1阻害を用いたメラノーマに対する新規免疫療法の開発を進めています。実際に、これまでの基礎研究をもとに、AMED橋渡し研究シーズCの援助のもと医師主導治験を実施し、ニボルマブ+PAI-1阻害薬併用療法の有効性・安全性を検証した。その結果、PAI-1阻害薬が一旦抗PD-1抗体耐性を獲得したメラノーマにおいてその薬剤耐性を解除し、併用期間が終了したにも関わらずその期間を遥かに超えた無増悪生存期間を維持することを証明しました。現在2025年3月を目安に、検証的第III相試験を準備しています。
上記、メラノーマ新規治療法の開発に加え、これまで我々は発癌・進行のメカニズムを抑制型免疫環境の観点を中心に行なってきました。中でも、メラノーマ内の腫瘍随伴性マクロファージ(Tumor-associated macrophages: TAMs)が数多くの抗腫瘍薬の作用ポイントであることに注目し、TAMsをターゲットとした治療法の開発に加えて、バイオマーカーとしてのTAMs関連物質を応用し、免疫チェックポイント阻害薬の治療効果・副作用予測システムの開発を行なっています。また、実臨床において紫外線や足底の外圧などの環境因子が関与することに着目し、メラノーマ発癌のみでなく、進行に紫外線や表皮細胞ストレス応答が関与するか否かを研究しています。また、弘前大学工学部・八戸高専との共同研究で皮膚悪性腫瘍診断機器の開発を2014年から行なっており、2025年に製版に向けた探索的治験を開始する予定です。以上、東北大学皮膚科では、メラノーマの研究を20年以上、多角的に行なっています。
マウスによる証明 TM5614は抗PD-1抗体の効果を増強する
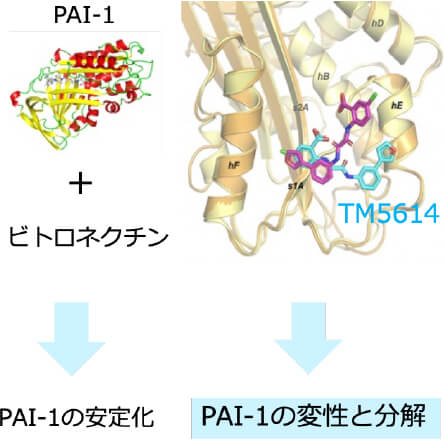
人への応用 ニボルマブ+TM5614臨床試験
皮膚がんに幅広く分布する腫瘍随伴性マクロファージ:その臨床応用
腫瘍随伴性マクロファージ(Tumor-associated macrophages: TAMs)は腫瘍内に分布する抑制型免疫細胞であり、末梢血中の単球として腫瘍内に遊走された後に、それぞれの癌種特有に発現する蛋白により機能を獲得し、独自の腫瘍内微小免疫環境を形成することが知られています。我々は、皮膚がんにおいても、ほぼ全ての癌種でCD163陽性TAMsが存在することに着目し、それぞれの癌種で腫瘍由来の蛋白がTAMsに与える影響を検討した。中でも乳房外パジェット病では、腫瘍細胞自体がRANKLとMMP7を発現することを発見しました。続いて、腫瘍細胞上の膜型RANKLがMMP7によりsRANKLとして放出されていること、sRANKLが腫瘍内のTAMsに作用し、CCL17 (TARC)の産生を亢進することにより腫瘍内に制御性T細胞(Tregs)を誘導しうることを乳房外パジェット病患者検体で証明しました。また、皮膚T細胞性リンパ腫 (cutaneous T cell lymphoma: CTCL)において、早期と進行期における腫瘍内間質のサイトカイン・パターンの違いに着目し、それぞれの病期においてTAMsが産生するケモカインの相違から腫瘍内浸潤細胞が変わること、さらにCTCL治療薬による介入がTAMsのケモカイン産生能に影響し副次的治療効果を発揮しうることを発表しました。他に、メルケル細胞癌、有棘細胞癌、基底細胞癌など多くの皮膚がんにおいてもTAMsが存在することを発表し、これらの結果を用いて現在、TAMsをターゲットとした癌種横断的皮膚がん治療を目指した治療法の開発を進めています。
腫瘍随伴性マクロファージとその応用

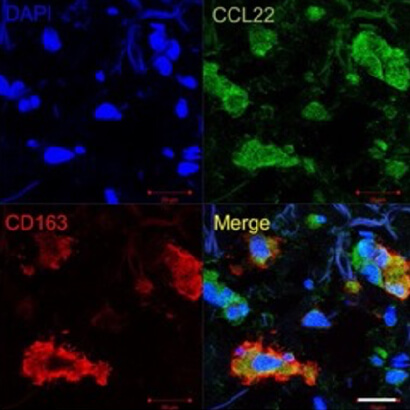

M2マクロファージとしての恒常性の維持 TAMsから放出されるsCD163が抗PD-1抗体が腫瘍内に到達したことを示すバイオマーカーになりうる。
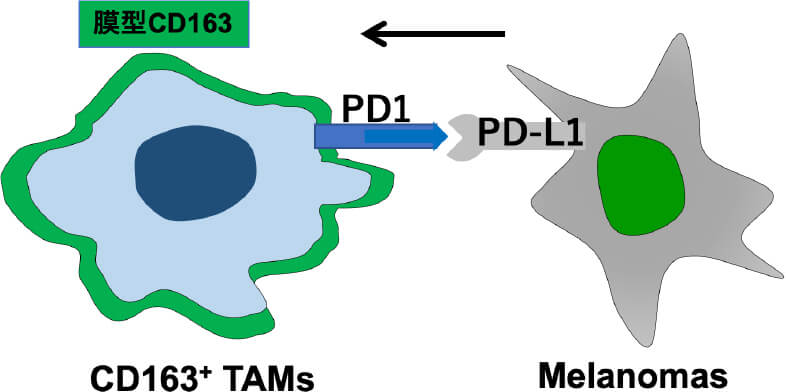
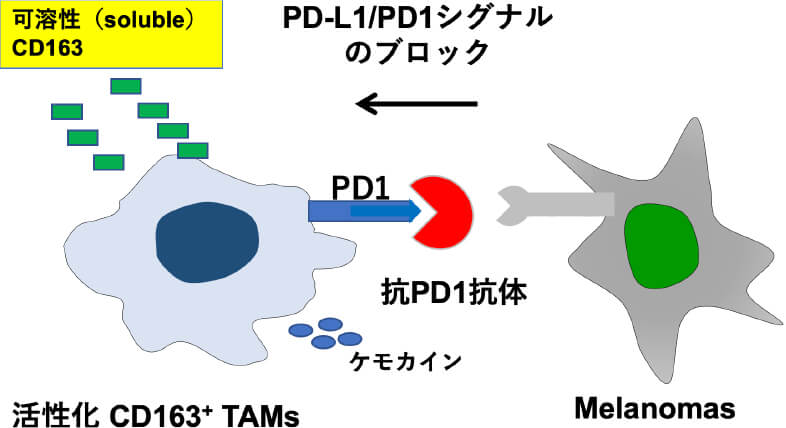
皮膚腫瘍における腫瘍進行と炎症反応
メラノーマをはじめとする皮膚がんは、その発症の誘引として紫外線、足底など持続する皮膚の刺激、慢性皮膚感染や熱傷など多くの原因が疫学的に知られています。しかしこれらの腫瘍免疫環境に与える影響はいまだ知られていないことが多いです。特に現在、我々は紫外線がDNA損傷に伴う発がんへの影響のみでなく、腫瘍免疫環境を変えることにより、腫瘍の進行を促進する可能性について、マウスB16F10モデルを用いて検討中です。実際に、UVBなど紫外線は皮膚科では古くより紫外線療法など炎症性皮膚疾患に対して免疫抑制目的で使用されている一方、過剰な使用により多発性有棘細胞癌など皮膚がんの誘発が起きることも臨床では知られています。これは過剰な紫外線が抑制型免疫細胞の腫瘍内への誘導を促進することが原因と考えられ、これを選択的に抑制することが将来的には早期皮膚がんの予防につながると考えています。また、古くから足底荷重部の母斑(ホクロ)はメラノーマ発症が多いことが知られているが、その詳細な腫瘍内免疫環境への影響は検討されていません。これまで我々は、末端黒子型メラノーマを中心に、表皮細胞ストレスにより誘導される抗菌ペプチドであるLL-37が、メラノーマの腫瘍の深部浸潤に関与することを報告しました。これらの結果は、荷重ストレスにより表皮細胞より産生されたLL-37が誘導する腫瘍内免疫環境がメラノーマの進行を促進することを示唆します。以上の結果は全て皮膚科では疫学上古くから知られていた現象を腫瘍免疫環境から解明することにより、今後、皮膚がん発症の予防・進展予防に寄与することが期待されます。
髙橋岳浩講師 Takehiro Takahashi
皮膚間質の細胞外マトリクス分子の皮膚疾患の免疫病態における役割の解明
エラスチン、コラーゲン、ヒアルロン酸といった細胞外マトリクスは、組織中に存在して単に組織間の間隙を埋めて構造的な支持組織として静的に存在するだけではなく、組織中における細胞の運動、増殖、分化、および生存に影響を与えるシグナルを制御したり、損傷後の組織修復と再生プロセスにおいて、損傷した細胞の再生し、新しい細胞の移動と定着のための基盤を提供することで、細胞表面受容体と相互作用し、隣接する細胞間で情報の伝達を仲介する、などの多様な機能を有します。本研究は、こういった細胞外マトリクスが、皮膚疾患の各種の免疫病態において、各免疫細胞の動態をどのように調整し、それらの疾患においてどのような役割を有しているのかを解明することを目指します。
内在性レトロエレメントの各種皮膚疾患における役割の包括的解明
内在性レトロエレメントはヒトゲノムの約50%を占め、進化の過程においてレトロウイルスなどのゲノムが宿主ゲノムに侵入・増幅した結果、構成された領域です。中でもヒトゲノムの約20%を占めるのがLong Interspersed Nuclear Element (LINE)-1とよばれるレトロエレメントであり、近年の研究により、LINE-1の制御異常・活性化が自己免疫、癌、神経変性などの病態に関与していることが示唆されています。本研究は各種皮膚疾患の病態におけるLINE-1の機能的役割を包括的に解明し、その知見を通じて新規治療アプローチ開発に資することを目的としています。
髙橋講師の
研究こぼれ話

研究は、うまくいかない、期待していたデータがでなくて辛いこともありますが、過去の偉大な発見もそうですがむしろ期待していたのと逆のデータがでたときにこそ大きな発見が隠れていることもあり、これが研究の面白いところです。
また、何かの現象を世界で初めて発見したときの喜びは何ものにもかえられませんし、医学の発展は研究なしにありえず、みんな日夜苦しみながらも楽しんでそれぞれの研究を進めています。

髙橋隼也講師 Toshiya Takahashi
カセリサイディンは自己RNAのスカベンジャー受容体への結合を誘導し炎症を促進する
抗菌ペプチドカセリサイディンの活性型(LL-37)およびそのペプチドライブラリー、損傷を受けた皮膚から放出される非コードdsRNAであるU1 RNAを培養角化細胞、マクロファージに加えdsRNAの細胞内への取り込みに与える影響を調べました。従来取り込む機序とされていたカセリサイディンによる細胞膜変化の関与は実際には小さく、LL-37存在下ではdsRNAが細胞表面のスカベンジャー受容体を介して取り込まれるという新しい機序を示しました。これはカセリサイディンにとって新たな炎症誘導機序であるだけでなく、スカベンジャー受容体やカセリサイディンを標的とした治療が抗炎症作用を持つ可能性を示すものです。
アトピー性皮膚炎および炎症性皮膚疾患の皮膚物理・免疫バリア機能における
抗菌ペプチドの役割
アトピー性皮膚炎(AD)は特徴的な皮疹と瘙痒を慢性に繰り返す代表的な炎症性皮膚疾患であり、患者のQoLを大きく低下させます。ADでは角層の剥離、セラミドなど表皮脂質の減少により表皮バリア機能が低下しており、ダニやカビ、汗といった悪化因子が容易に表皮内に吸収されます。また表皮からの水分蒸散量が増え皮膚は乾燥し、さらなるADの増悪を引き起こします。このため保湿剤などスキンケアによるバリア機能の補正はアトピー治療において必須であり、また経表皮水分蒸散量(transepidermal water loss, TEWL)は皮膚物理バリア機能の指標として用いられます。
一方、抗菌ペプチドは20-60アミノ酸残基から成り、多くは陽荷電と両親媒性を有します。陰荷電した細菌・真菌細胞壁や細胞膜、ウイルスのエンベロープに穿孔して直接抗菌・抗ウイルス作用を示すだけでなく、宿主免疫細胞の走化性、細胞増殖作用、DAMPsの細胞内取り込み促進といった種々の免疫機能の調整作用を有します。ヒト抗菌ペプチドの多くは上皮系細胞や好中球といった自然免疫機構を担う細胞により産生され、皮膚の免疫学的バリアに重要な役割を果たすことが知られています。
多くの炎症性皮膚疾患では皮膚の抗菌ペプチド量は増加しますが、アトピー性皮膚炎では減少しています。この減少が伝染性膿痂疹や伝染性軟属腫、カポジ水痘様発疹症といった皮膚感染症がアトピー性皮膚炎で生じやすい理由の一つであると考えられますが、減少する機序は知られていません。抗菌ペプチドを外用で補充することで皮膚細胞を障害せず、免疫機能を高めながら、耐性菌も生じずに抗菌作用を発揮できるのではと期待されます。
そこで、TEWLと抗菌ペプチドに関連があるか、保湿剤による物理的バリア機能の是正が抗菌ペプチドの含有量改善という免疫学的バリア機能改善につながるか、抗菌ペプチドの補充により皮膚感染症が改善するかを検証し、皮膚の免疫バリア機能を高める新たなスキンケアを目指します。
髙橋講師の
研究こぼれ話

仮説と違った結果となっても、それが失敗とは限らないのが研究の魅力です。
留学先で予測とは違ったデータが出たのですが、それがきっかけで論文となったことがあります。転機となるデータをボスに見せたときに言われた、”Congratulations. You've grabbed a serendipity."という言葉は一生の宝物です。
実験のデータを最初に見て、その結果に一喜一憂できるのは、指導者にはない実験者の特権です。チャンスがあれば、ぜひその興奮・感動を自ら体験してほしいと思います。

藤村准教授の
研究こぼれ話
「縁起の良い日、縁起の良い月」
長年研究をしていると、不思議なことに縁起の良い月、縁起の良い日ができてくるものです。なぜ?と思う人も多いでしょうが、これら日付は、実は研究成果を論文にするとき実験ノートを繰り返し読むために自然と記憶されます。私の場合ですと、10月は縁起の良い月、特に10月18日が縁起の良い日になります。これは、北海道大学で研究を始めた初年度に初めのデータがでた日になります。毎年この日が近づくとなんとなく嬉しい気分になります。皆さんの縁起の良い月はいつになるでしょうか。