RESEARCH 研究詳細 髙橋岳浩講師
皮膚間質の細胞外マトリクス分子の皮膚疾患の免疫病態における役割の解明
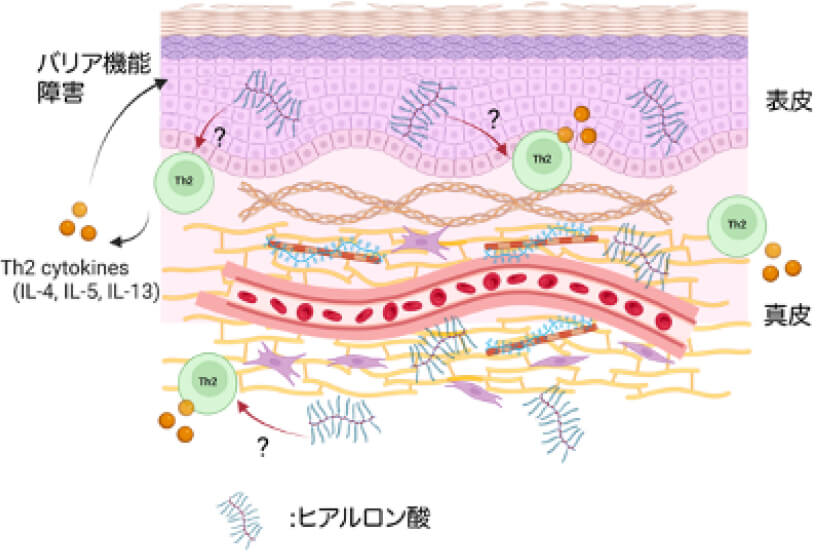
図1.ヒアルロン酸がアトピー性皮膚炎と皮膚のTh2免疫応答に関与する影響
エラスチン、コラーゲン、ヒアルロン酸といった細胞外マトリクスは、組織内に存在し、単に組織間の隙間を埋めるだけでなく、構造的な支持を提供する静的な存在としてだけではなく、組織内での細胞の運動、増殖、分化、および生存に影響を与えるシグナルを制御したり、損傷後の組織修復と再生プロセスにおいて、損傷した細胞の再生を助け、新しい細胞の移動と定着のための基盤を提供することで、細胞表面受容体と相互作用し、隣接する細胞間で情報の伝達を仲介するなどの多様な機能を持っています (Frantz C et al., J Cell Sci, 2010)。
特に、D-グルクロン酸とN-アセチル-D-グルコサミンの2糖が連結された直鎖状の高分子化合物であるヒアルロン酸は、細胞外マトリクスの主要な構成成分であり、水分保持、組織の弾力性維持、バリア機能の支持といった基本的な役割を果たすだけでなく、細胞の移動やシグナル伝達などに深く関わる重要な要素です。特に近年の研究では、細胞表面のレセプターや結合分子との相互作用を通じて、組織修復、胚の発生、炎症反応、および腫瘍の成長と転移などの多様な生物学的プロセスにおいて、中心的な役割を果たしていることが明らかになっています。ヒトをはじめとする哺乳類のヒアルロン酸合成は、ヒアルロン酸合成酵素(Hyaluronan Synthase:HAS)の3つのアイソフォーム HAS1, HAS2, HAS3によって行われますが、興味深いことに、これらの合成酵素から作られるヒアルロン酸は、その分子量によって大きく異なる生物学的作用を示すことが知られています (Itano N et al., IUBMB Life, 2002)。HAS1, HAS2によって合成される高分子ヒアルロン酸は血管新生を抑制し、抗炎症作用や免疫抑制作用がありますが、HAS3によって合成される低分子ヒアルロン酸は一般的に血管新生を促進し、炎症の亢進作用、免疫刺激作用、抗アポトーシス活性を示します (Petrey AC et al., Front Immunol, 2014)。様々な疾患におけるヒアルロン酸の役割について研究されていますが、特に近年は悪性腫瘍の分野での研究が進んでおり、ヒアルロン酸が腫瘍の成長、進行、転移に影響を与える重要な要因であることや、低分子量ヒアルロン酸が腫瘍の悪性度と転移能を高め、腫瘍微小環境内における免疫応答を抑制することにより、腫瘍の成長を促進する可能性があることが示されています。炎症性皮膚疾患におけるヒアルロン酸の具体的な役割や作用についても、いくつかの優れた先行研究がありますが、その全容はまだ完全には解明されていません。
本研究は、アトピー性皮膚炎、乾癬、全身性強皮症といった各種皮膚疾患におけるヒアルロン酸、特にHAS1/2/3酵素によって合成されるヒアルロン酸の役割を探求し、それがこれらの疾患の病態における炎症免疫応答、特にTh1/2/17免疫応答をどのように調節するかを明らかにすることを目的としています (図1)
内在性レトロエレメントの各種皮膚疾患、特に自己免疫疾患における
役割の包括的解明
図1.ヒトとマウスのゲノム構成
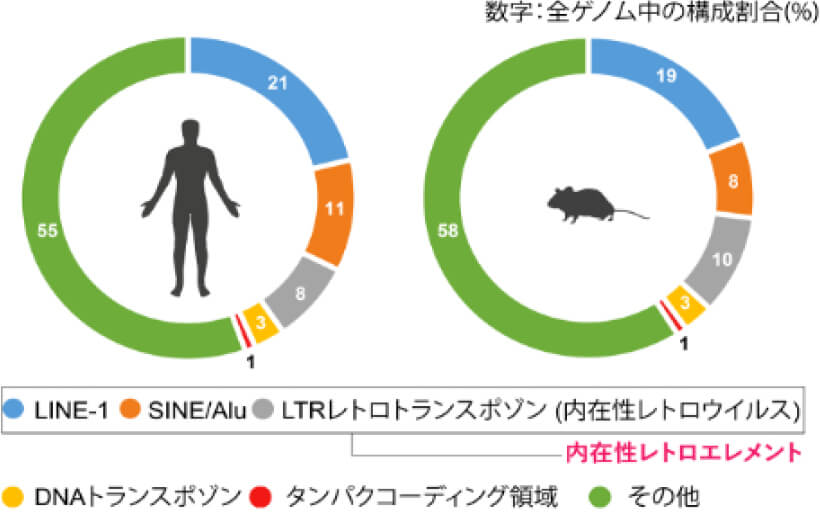
ヒトゲノムのタンパク質コーディング領域は、全体のわずか2%に過ぎませんが、一方で約50%が高度に反復的なレトロウイルスやレトロトランスポゾン由来の配列、つまり内在性レトロエレメントで占められています (Lander ES et al., Nature, 2001)(図1)。これらの配列は、もともとは外来であり「非自己」であったレトロトランスポゾンなどの配列が進化の過程で生殖細胞系に取り込まれて「自己」となり、その後増幅を重ねて現在のように大きな遺伝子領域を占めるようになりました。近年の爆発的な研究の進展により、かつて「ジャンク(ごみ)」と呼ばれていたこのレトロエレメント配列が、生理的に不可欠な役割を果たすこと、さらに自己免疫疾患、癌、神経変性疾患、老化といった生理現象においても決定的な役割を果たすことが明らかにされつつあります (Burns KH., Ann Rev Pathol, 2020)。
元来「非自己」であったゲノム因子は、その増幅過程で宿主のゲノム不安定性をもたらす危険な存在ですが、進化の過程で多くに変異や欠失が導入され、エピジェネティック機序や転写因子を介したサイレンシングにより、ゲノム安定性が維持されるよう抑制されています。特に、かつて外来のレトロトランスポゾンであったLINE-1はヒトゲノム中に約50万コピー存在しますが、そのほとんどは逆転写酵素などをコードする領域に欠失や変異があります。しかし、進化的に「若い」ファミリー、つまり進化の直近に挿入・増幅した100-200コピーは完全な配列を保持しており、そのmRNAから逆転写酵素によりcDNAが合成され、再びゲノムに挿入される「コピー&ペースト」の活性を保っています (Kazazian HH et al., N Engl J Med, 2017)。この若いLINE-1の再活性化や発現上昇は、DNA傷害やLINE-1 cDNAによるcGAS-STING経路の刺激を介したI型インターフェロン経路の活性化により、疾患病態に関与することが分かっています。また、ヒト免疫不全ウイルス(HIV)に対して使用される逆転写酵素阻害薬がLINE-1の逆転写酵素を抑制し、LINE-1の過剰活性化を介した病態を改善する可能性も示されています (Gorbunova V et al., Nature, 2021)。全身性エリテマトーデス(SLE)などの自己免疫疾患や皮膚炎症性疾患においても、末梢血細胞や皮膚におけるLINE-1/レトロエレメントの発現上昇が報告されています (Lima-Junior DS et al., Cell, 2021, Tokuyama M et al., J Exp Med, 2021, Mavragani C et al., Arthritis Rheum, 2016, Hung T et al., Science, 2015)。しかし、多くはその発現量と臨床パラメータの相関を検討した観察研究にとどまり、「生体内のどの細胞におけるLINE-1の活性化が、どのような機序で機能的に自己免疫病態を引き起こすか」という問いの解明は、まだ進んでいません。
本研究では、皮膚および免疫細胞におけるLINE-1の活性化が、いかにして自己免疫の病態を引き起こすかについてのメカニズムを解明することを目指します。
